Muchas vueltas solemos dar los profesionales sanitarios implicados en la rehabilitación del paciente neurológico, donde el constante reciclaje, las formaciones, la investigación, los avances tecnológicos, etc. están en constante cambio y evolucionan en favor a los afectados (sujetos de investigación).
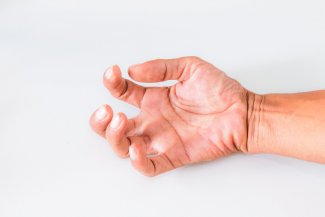
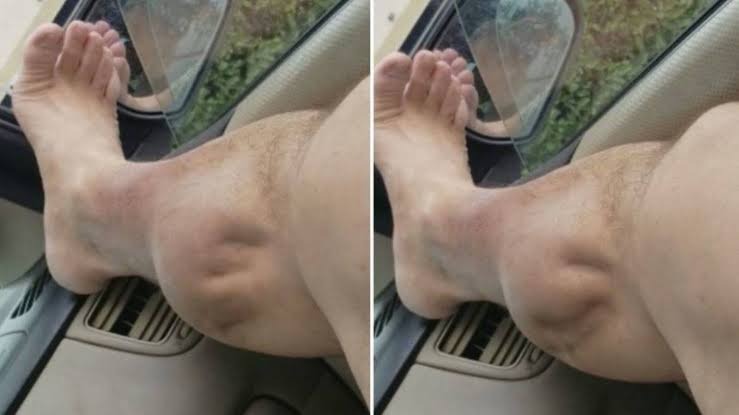
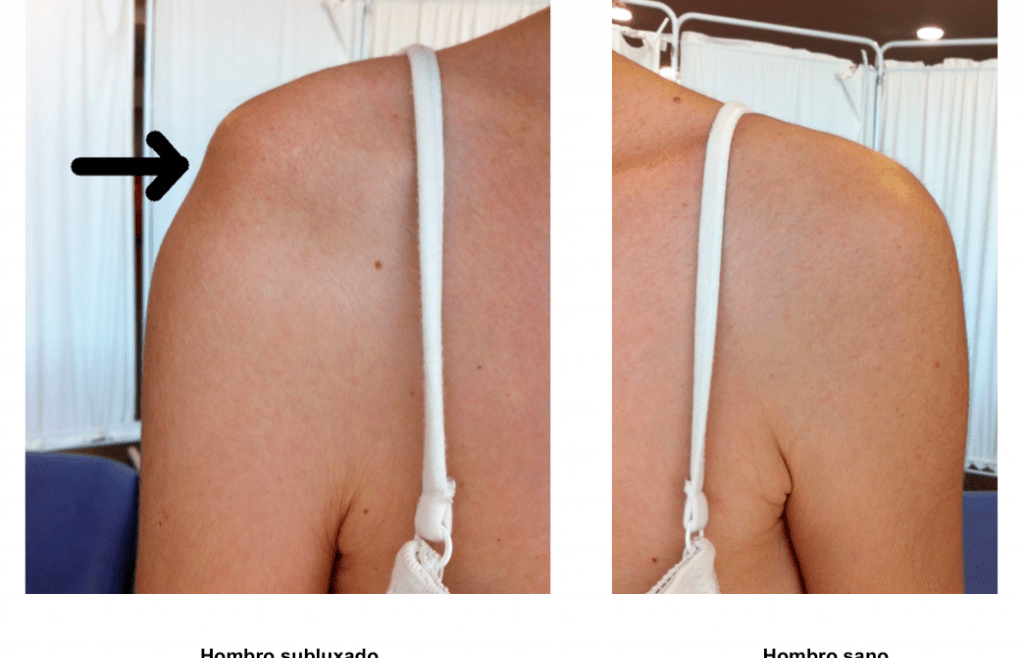
El paciente con ictus crónico (tiempo-dependiente), suele tener una recuperación complicada, ya que no solo ha instaurado una serie de aprendizajes y adaptaciones en medida de lo que ha ido desarrollando en su vida diaria, sino que ha pasado una oportunidad de reorganización tras el periodo agudo que optimizaría el proceso de recuperación en caso que no se haya hecho ningún tipo de rehabilitación.
Aún así, nunca nos damos por vencidos, ya que negar la evidencia de recuperación en personas que han sufrido un ictus hace años (nos referimos a déficit, funcionalidad y desempeño, para su calidad de vida), suele ser por desconocimiento, ya que las mejoras en la participación de la vida de una persona, son más que bienvenidas, y pueden ser objetivos específicos para las personas afectadas.
La evidencia científica nos muestra el camino experimental que han podido estudiar los profesionales sanitarios dedicados a este terreno, con resultados analizados y medidos, cambios clínicos interesantes y sobretodo, calidad de vida, independencia funcional y autonomía.
Es por ello, que el siguiente estudio del 2019 lo encontramos más que interesante:
«Long-Dose Intensive Therapy Is Necessary for Strong, Clinically Significant, Upper Limb Functional Gains and Retained Gains in Severe/Moderate Chronic Stroke».
En este estudio, 36 sujetos con ictus crónico, realizaron un trabajo específico de recuperación de la extremidad superior, desde el paraguas del control motor y la fuerza, así como la Estimulación Eléctrica Funcional, terapia espejo y la Robótica [(Vectra Pro (Chatanooga Group, Inc, Hixson, TN) y InMotion2)], dependiendo de la necesidad de un trabajo más distal o proximal (según mayor afectación).
La duración del trabajo, fue de 5 horas al día, 5 días a la semana, durante 12 semanas, lo que implica más de 300 horas en el total del estudio. Además, se midieron mediante test, el déficit como la Fugl-Meyer, la funcionalidad mediante Arm Motor Ability Test (AMAT) y la Stroke Impact Scale (SIS) para la percepción de cuánto han recuperado la extremidad superior.
Los resultados muestran mejoras estadísticamente significativas y clínicamente relevantes en el déficit (de hasta 10 puntos en el test de Fugl-Meyer, que son muchos), en la funcionalidad (AMAT) mediante el entrenamiento de las tareas, así como en la percepción de mejora del paciente (lo que implica una adherencia considerable al tratamiento).
De hecho, gracias a estas mejoras, junto con la adherencia, los cambios se mantenían al cabo de 3 meses de duración tras la finalización de la intervención, donde los pacientes continuaban realizando las tareas de la vida diaria sobre las que fueron entrenadas durante el tratamiento, en especial énfasis en el control motor.
Este estudio implica cosas bastante interesantes, donde el paradigma del más y mejor, se vuelve favorable en el paciente con ictus crónico. La oferta de tratamiento en España no suele ser de este tipo (aunque sí existen unos pocos centros que la ofertan), ni en dosis, ni intensidad, ni duración, ni tipo de intervención. Ahora, sabemos el camino, necesitamos hacer el esfuerzo de cambiar lo que se ofrece a los pacientes con ictus crónico.
Para descargar el artículo: https://journals.sagepub.com/doi/full/10.1177/1545968319846120?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%3dpubmed